 打印本文
打印本文  关闭窗口
关闭窗口 重点难点: 酸的通性;常见金属的化学活动性顺序的识记和应用。
教学方法:复习、归纳和实验相结合。
教学用具、仪器:试管、滴管、镊子、培养皿、投影仪。
药品:稀盐酸、稀硫酸、氢氧化钠溶液、酚酞试液、石蕊试液、镁条、锌粒、铜片。
教学过程:
[提出问题,引入新课] 上节课我们学习了盐酸和稀硫酸,那么,盐酸和稀硫酸有哪些相似的化学性质?为何有这样相似的性质?并写出盐酸、硫酸和硝酸的电离方程式,从中发现了什么?
思考、讨论,书写电离方程式并回答问题:
HCl=H++Cl-
H2SO4=2H++SO42-
HNO3=H++NO3-
[讲述] 酸类在水溶液中都能电离出相同的阳离子—H+,所以它们具有一些共同的化学性质,即酸的通性。
[板书] 第三节 酸的通性PH值
酸的通性
1.酸溶液跟酸碱指示剂的作用
归纳总结酸与指示剂的作用并记忆。
2.酸与活泼金属反应生成盐和氢气。
[演示实验] 将培养皿放在投影仪上,倒入1:2稀盐酸,用塑料板条将其隔成四等份,分别放在镁条、锌粒、铁钉和铜片四种金属(实验前在投影仪玻璃上写好Mg、Zn、Fe、Cu)字样,再用漏斗分别罩住镁条和锌粒,用火柴燃生成的气体。
观察实验现象,比较四种金属与盐酸反应的速率,分析思考找规律,并写出有关化学方程式。
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Cu与HCl不反应.
[设问] 根据实验事实思考:什么样的金属与何种酸反应才能放出氢气呢?
通过探索实验使学生认识金属活动性的强弱及其活动性顺序。
金属活动性顺序:K 、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属:活动性顺序中“H”前的金属
酸:盐酸或稀硫酸
[板书] 金属与酸 反应规律: 金属+酸→盐+氢气 (HNO3和浓H2SO4除外)
3.酸跟碱性氧化物反应生成盐和水
提问:什么叫碱性氧化物?
明确:凡能跟酸起反应生成盐和水的氧化物,叫做碱性氧化物。如:CuO、Fe2O3、MgO等
指出:金属氧化物大多是碱性氧化物。
金属氧化物中,Na2O、K2O、CaO溶于水,并与水发生反应生成可溶性碱。
如:Na2O+H2O==2NaOH
CuO、MgO等不溶于水,也不于水发生反应。
4.酸和碱起中和反应生成盐和水。
[设问]盐酸与氢氧化钠反应,怎样证明两者恰好反应?
思考讨论,回答。用指示剂变色来证明。
做实验8-20,逐滴一振荡一刚变无色为止
记录实验现象,指出反应物、生成物及其类别,总结出酸和碱反应生成盐和水的规律。
提问:什么叫中和反应?中和反应属于哪种基本反应类型?
明确:酸和碱作用生成盐和水的反应叫中和反应。中和反应是复分解反应的一种。
反应规律:酸+碱→盐+水
[提出问题]试举出中和反应在生产和生活中应用的例子。
5.酸跟盐反应生成另一种酸和另一种盐.
回忆:已学过的酸、盐之间反应的化学方程式 。
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
[学生小结] 我们学习了酸的通性,通性是一般规律,可以指导我们学习,但规律有一定适用范围,所以也要注意个别现象。
试进行小结,体会本节内容。
对学生进行由个别到一般的认识事物方法的教育,学会用“规律”指导学习的科学方法。
课题:酸的通性 PH值(第二课时)
重点难点:溶液的PH值及其应用。
教学方法:实验、阅读、讲解、归纳相结合。
教学用品、仪器:试管、表面皿、玻璃棒、投影仪。
药品:PH试纸、稀盐酸、氢氧化钠溶液。
其它: 土壤样品。
教学过程:
[练习]写出HCl、H2SO4、HNO3的电离方程式。
指导学生正确书写化学用语。
写出电离方程式:
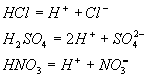
[设问] 上节课我们总结了酸的五点通性,酸为什么具有相似的化学性质?
思考并回答:电离时产生的阳离子全部是氢离子。
[提问]酸有哪些通性?
在学生回答的基础上小结。
[过渡语] 我们学习了酸的如何命名?如何给酸进一步分类呢?
[板书]
1.酸的分类和命名
指导学生阅读课文P.162
通过读书,总结出酸的分类和命名。
[板书]
(1)分类:
根据酸分子中是否含氧分为 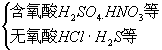
根据酸分子中电离出氢离子个数分为 
命名:
含氧酸:“某酸”如H2SO4硫酸
无氧酸:“氢某酸”如H2S氢硫酸
[过渡语] 在生活中,人们往往不但需要知道某溶液的酸碱性,还需要知识溶液酸碱性的相对强弱,溶液酸碱性的强弱如何表示?
[板书]
2.PH—酸碱度的表示方法
[指导阅读]
指导学生阅读教材P.163
阅读教材并自己总结出PH值的范围及溶液PH值的三种情况
[板书]PH范围通常在0~14之间
PH=7 溶液呈中性
PH>7 溶液呈碱性
PH <7 溶液呈酸性
[引入问题] 溶液的PH值用什么方法测定?用PH试纸。
展示PH试纸
[指导学生实验] 做课本P.163 实验(8-21)和(实验8-22)
分组实验
[指导学生阅读课文]阅读课文P.164及表8-1和表8-2.
[指导学生小结] 本节课学习了酸的分类和命名,重点学习了PH——溶液酸碱度的表示方法,这不仅从理论上知道了溶液酸碱度对生活、生产及科研的重要意义,还将对今后的实际应用起指导作用。
 打印本文
打印本文  关闭窗口
关闭窗口